レケンビ
臨床成績 国際共同301試験 Core Study
有効性
CDR-SBのベースラインからの変化量(各評価時点)[18ヵ月:主要評価項目(検証的解析結果)]
主要評価項目(検証的解析結果)である投与18ヵ月後におけるCDR-SBのベースラインからの変化量(調整済み平均値)は、プラセボ群1.66、レケンビ群1.21、その差は-0.45であり、レケンビ群ではプラセボ群と比較して有意な悪化抑制が示され(27.1%抑制、p<0.001、MMRM)、レケンビ群のプラセボ群に対する優越性が検証された。また、レケンビ群では、投与 6、9、12、15ヵ月後の評価時点において、プラセボ群と比較して有意なCDR-SBの悪化抑制が示された(投与6、9ヵ月後はp<0.01、投与12、15ヵ月後はp<0.001、MMRM)。
CDR-SBのベースラインからの変化量
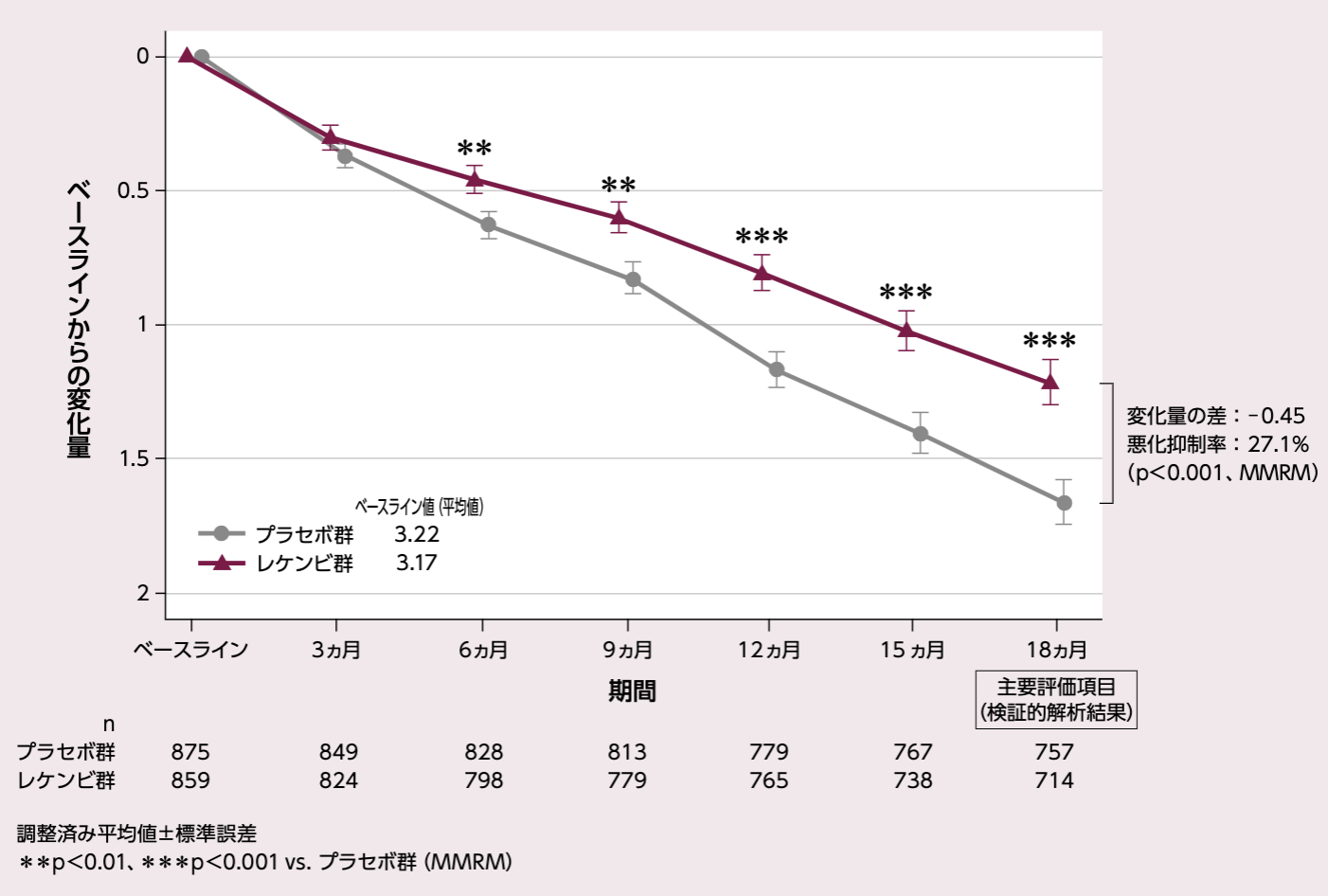
固定効果:投与群、評価時点、無作為化時の層別因子(疾患ステージ[MCI due to ADまたは軽度アルツハイマー型認知症]、AD症状改善薬のベースライン時の併用有無[AChEIおよび/またはメマンチン]、ApoE ε4 保因状況[キャリアまたはノンキャリア]、地域[北米、オーストラリアを含む欧州、中国を除くアジア太平洋地域])、CDR-SBのベースライン値と評価時点との交互作用、投与群と評価時点との交互作用項
ADCS MCI-ADLのベースラインからの変化量(各評価時点)
[18ヵ月:重要な副次評価項目]
投与18ヵ月後におけるADCS MCI-ADLのベースラインからの変化量(調整済み平均値)は、プラセボ群- 5.50、レケンビ群 - 3.48、その差は2.02であり、レケンビ群ではプラセボ群と比較して有意なADCS MCI-ADLの悪化抑制が示された(36.6%抑制、p<0.001、MMRM)。
レケンビ群では、投与6、12ヵ月後の評価時点において、プラセボ群と比較して有意な悪化抑制が示された(投与6ヵ月後はp<0.01、投与12ヵ月後はp<0.00001、MMRM)。
ADCS MCI-ADL のベースラインからの変化量
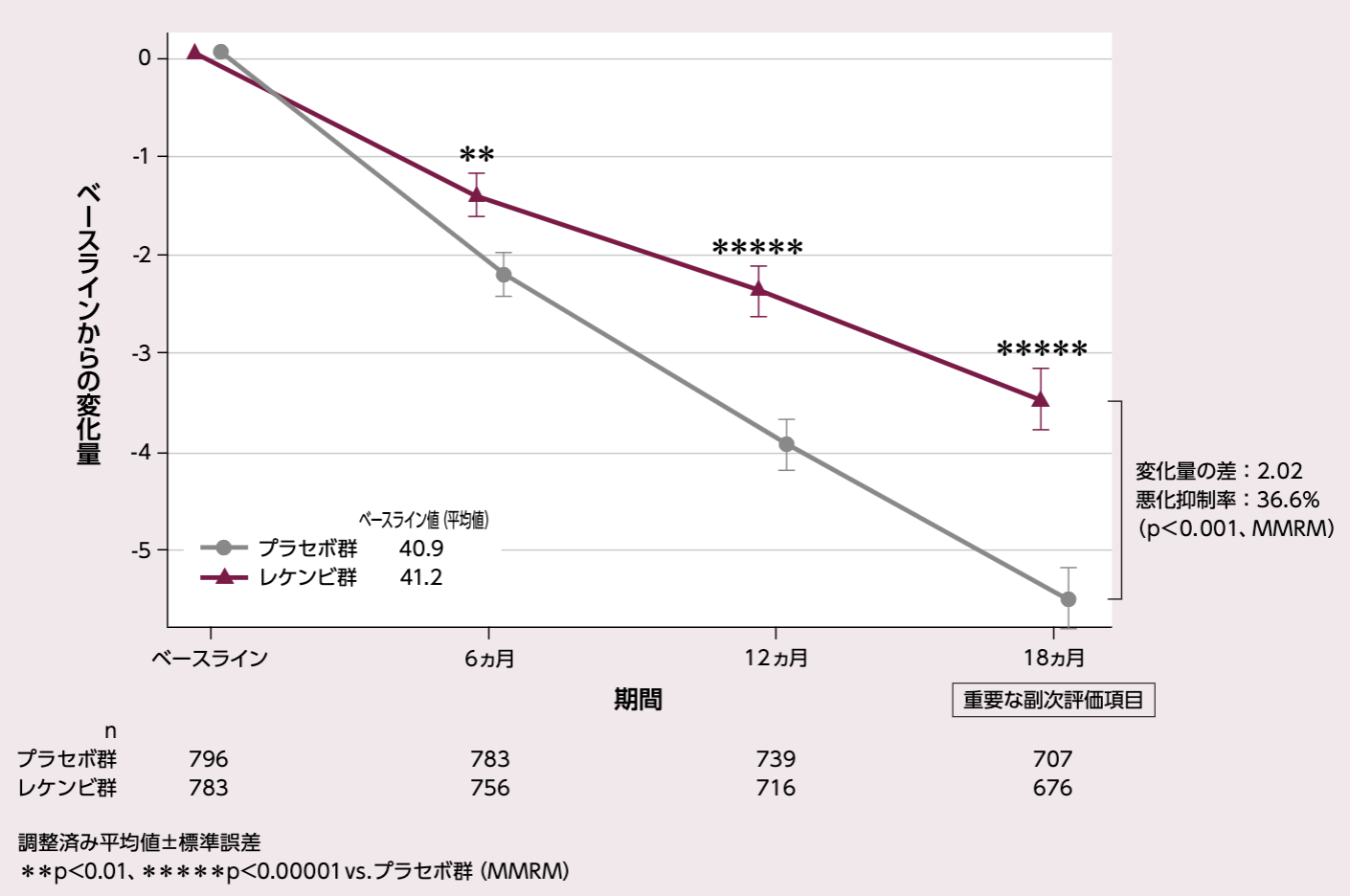
固定効果:投与群、評価時点、無作為化時の層別因子(疾患ステージ[MCI due to ADまたは軽度アルツハイマー型認知症]、AD症状改善薬のベースライン時の併用有無[AChEIおよび/またはメマンチン]、ApoE ε4 保因状況[キャリアまたはノンキャリア]、地域[北米、オーストラリアを含む欧州、中国を除くアジア太平洋地域])、ADCS MCI-ADLのベースライン値と評価時点との交互作用、投与群と評価時点との交互作用項
ADCOMSのベースラインからの変化量(各評価時点)
[18ヵ月:重要な副次評価項目]
投与18ヵ月後におけるADCOMSのベースラインからの変化量(調整済み平均値)は、プラセボ群0.21、レケンビ群0.16、その差は - 0.05であり、レケンビ群ではプラセボ群と比較して有意なADCOMSの悪化抑制が示された(23.5%抑制、p<0.001、MMRM)。
レケンビ 群では、投与 6、9、12、15ヵ月後の評価時点において、プラセボ群と比較して有意なADCOMSの悪化抑制が示された(投与6ヵ月後はp<0.01、投与9ヵ月後はp<0.001、投与12、15ヵ月後はp<0.0001、MMRM)。
ADCOMSのベースラインからの変化量
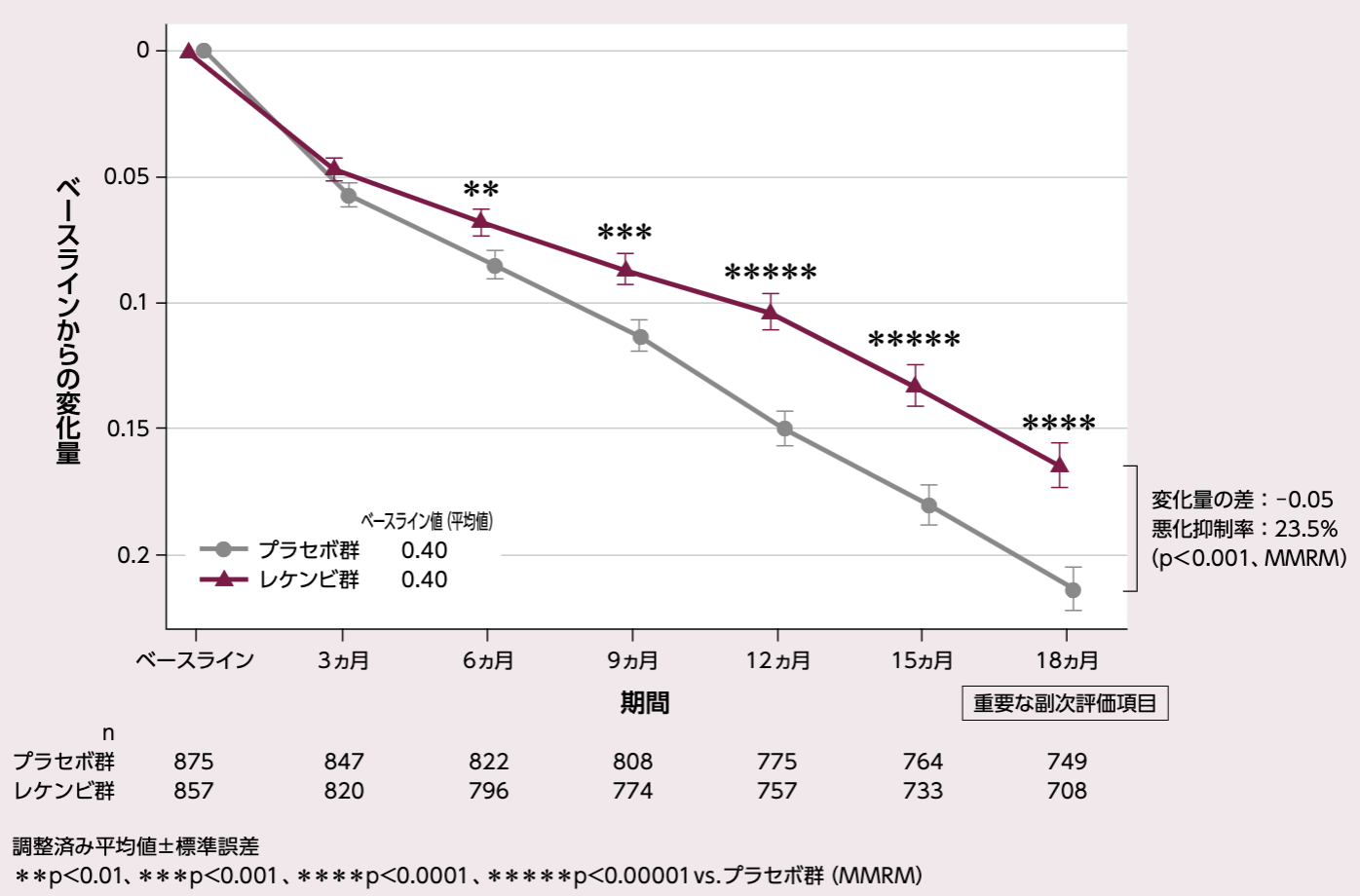
固定効果:投与群、評価時点、無作為化時の層別因子(疾患ステージ[MCI due to ADまたは軽度アルツハイマー型認知症]、AD症状改善薬のベースライン時の併用有無[AChEIおよび/またはメマンチン]、ApoE ε4 保因状況[キャリアまたはノンキャリア]、地域[北米、オーストラリアを含む欧州、中国を除くアジア太平洋地域])、ADCOMSのベースライン値と評価時点との交互作用、投与群と評価時点との交互作用項
ADAS-Cog14のベースラインからの変化量(各評価時点)
[18ヵ月:重要な副次評価項目]
投与18ヵ月後におけるADAS-Cog14のベースラインからの変化量(調整済み平均値)は、プラセボ群5.58、レケンビ群4.14、その差は - 1.44であり、レケンビ群ではプラセボ群と比較して有意なADAS-Cog14の悪化抑制が示された(25.8%抑制、p<0.001、MMRM)。レケンビ群では、投与 6、9、12、15ヵ月後の評価時点において、プラセボ群と比較して有意なADAS-Cog14の悪化抑制が示された(投与6ヵ月後はp<0.05、投与9、12、15ヵ月後はp<0.0001、MMRM)。
ADAS-Cog14 のベースラインからの変化量
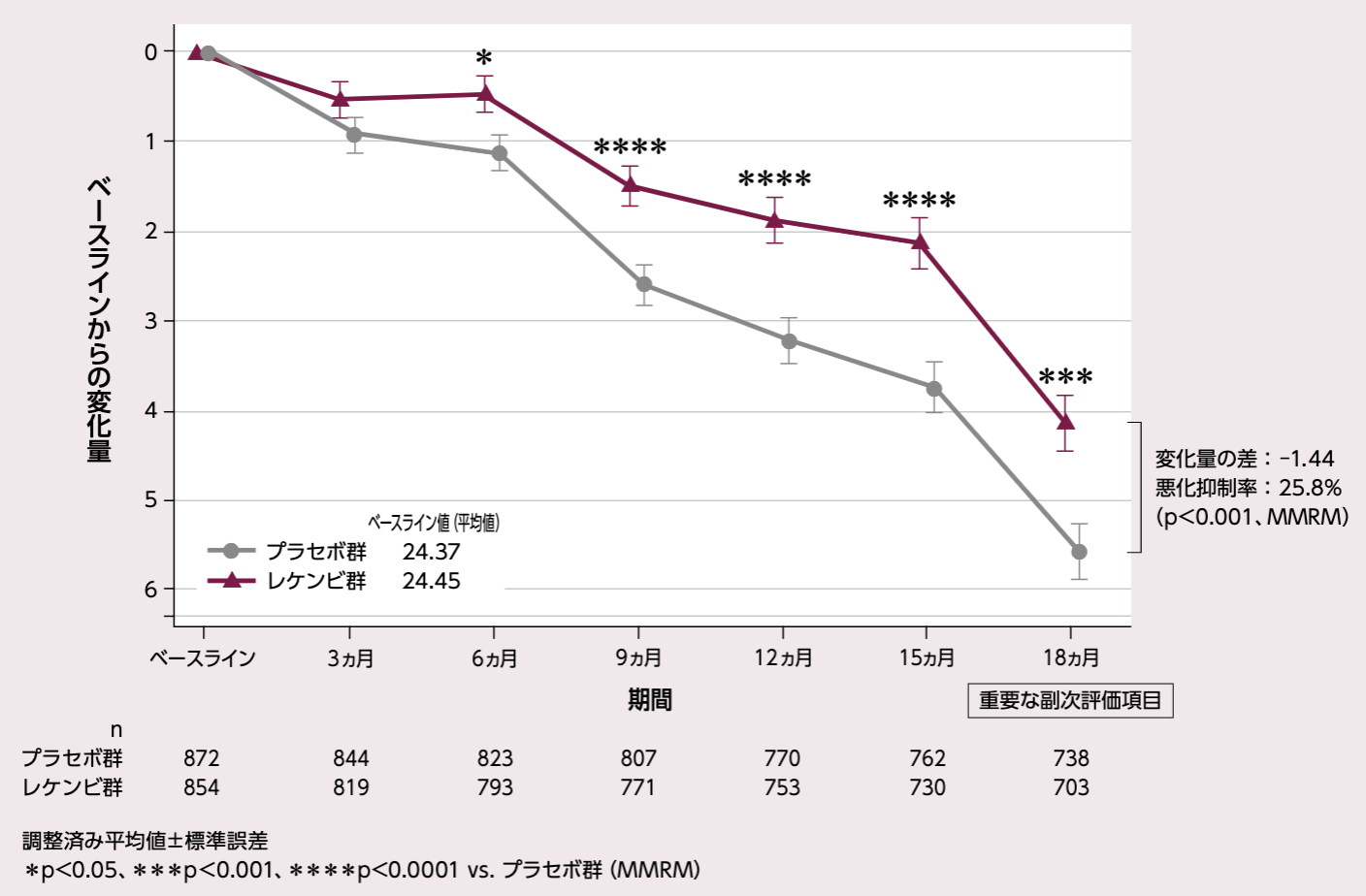
固定効果:投与群、評価時点、無作為化時の層別因子(疾患ステージ[MCI due to ADまたは軽度アルツハイマー型認知症]、AD症状改善薬のベースライン時の併用有無[AChEIおよび/またはメマンチン]、ApoE ε4 保因状況[キャリアまたはノンキャリア]、地域[北米、オーストラリアを含む欧州、中国を除くアジア太平洋地域])、ADAS-Cog14のベースライン値と評価時点との交互作用、投与群と評価時点との交互作用項
アミロイドPETセンチロイドスケールを指標とした
脳内アミロイドβ蓄積量のベースラインからの変化量(各評価時点)
[18ヵ月:重要な副次評価項目]
レケンビ群では、ベースラインのセンチロイドスケールの平均値は77.92であったが、投与18ヵ月後には22.99となり、アミロイド陽性の閾値である30※を下回った。
投与18ヵ月後におけるセンチロイドスケールの変化量(調整済み平均値)は、プラセボ群3.64、レケンビ群- 55.48、その差は - 59.12であり、レケンビ群ではプラセボ群と比較して脳内アミロイドβ蓄積量の有意な減少が認められた(p<0.001、MMRM)。
レケンビ群では、投与 3、6、12ヵ月後の評価時点において、プラセボ群と比較して有意な脳内アミロイドβ蓄積量の減少が示された(投与3、6、12ヵ月後で p<0.00001、MMRM)。
※ アミロイドPET SUVrの閾値1.17に対応するセンチロイドスケールの閾値は30と定義した。視覚読影で脳内アミロイド蓄積を判定した場合の境界はセンチロイドスケールの25~35.7に相当し、30の閾値はこの範囲内にある[Rowe CC, et al.: J Nucl Med. 2018;59(Suppl. 1): 482、AmadoruS, et al.: Alzheimers Res Ther. 2020; 12(22)、Roé-Vellvé N, et al.: Alzheimer's Dement.2020;16(Suppl. 5): e042933、Bullich S, et al.:Alzheimers Res Ther. 2021; 13: 67]。また,病理組織学的にAβ病理の有無を確認した場合[Rowe CC, et al.: Eur J Nucl Med Mol Imaging.2017; 44: 2053‒2059]並びにCSF中のt-tau/Aβ42 比およびp-tau/Aβ42 比の閾値に基づき脳内アミロイド蓄積を判定した場合[Salvadó G, et al.:Alzheimers Res Ther. 2019; 11(27)]の境界もセンチロイドスケールに換算するとこの閾値と整合する。
アミロイド PET センチロイドスケールのベースラインからの変化量
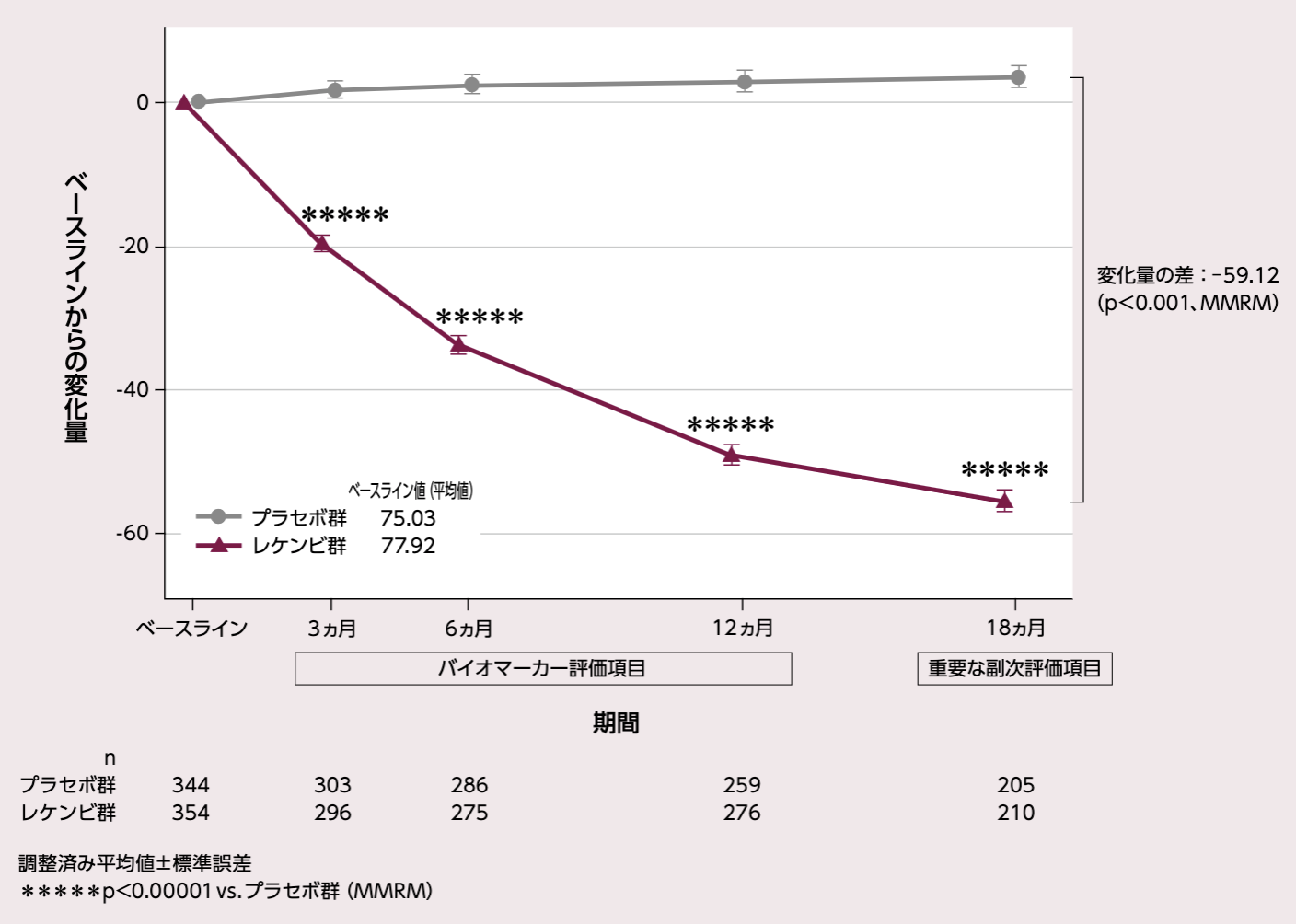
固定効果:投与群、評価時点、無作為化時の層別因子(疾患ステージ[MCI due to ADまたは軽度アルツハイマー型認知症]、AD症状改善薬のベースライン時の併用有無[AChEIおよび/またはメマンチン]、ApoE ε4 保因状況[キャリアまたはノンキャリア]、地域[北米、オーストラリアを含む欧州、中国を除くアジア太平洋地域])、アミロイドPETセンチロイドスケールのベースライン値と評価時点との交互作用、投与群と評価時点との交互作用項
安全性
副作用
副作用の発現率は、プラセボ群22.0%(197/897例)、レケンビ群44.7%(401/898例)であった。
主な副作用は、プラセボ群では、アミロイド関連画像異常-微小出血およびヘモジデリン沈着7.5%(67例)、注入に伴う反応7.1%(64例)、脳表ヘモジデリン沈着症2.2%(20例)、アミロイド関連画像異常-浮腫/滲出液貯留1.7%(15例)、レケンビ群では、注入に伴う反応26.1%(234例)、アミロイド関連画像異常-微小出血およびヘモジデリン沈着13.6%(122例)、アミロイド関連画像異常-浮腫/滲出液貯留12.6%(113例)、脳表ヘモジデリン沈着症5.2%(47例)、頭痛1.8%(16例)であった。
重篤な副作用は、プラセボ群では、心房細動、脳梗塞、認知障害発作、くも膜下出血および巨細胞性動脈炎が各1例であった。レケンビ群では、注入に伴う反応11例、アミロイド関連画像異常-浮腫/滲出液貯留7例、アミロイド関連画像異常-微小出血およびヘモジデリン沈着2例、口の感覚鈍麻、過敏症、再発非ホジキンリンパ腫、感覚鈍麻および急性腎障害が各1例であった。
死亡に至った副作用は認められなかった。
投与中止に至った副作用は、プラセボ群では、過敏症、転倒、注入に伴う反応、肝酵素上昇、リウマチ熱、アミロイド関連画像異常-微小出血およびヘモジデリン沈着、浮動性めまい、嗜眠、片頭痛、痙攣発作、くも膜下出血、失神および類天疱瘡が各1例であった。レケンビ群では、アミロイド関連画像異常-微小出血およびヘモジデリン沈着15例、アミロイド関連画像異常-浮腫/滲出液貯留13例、注入に伴う反応12例、脳表ヘモジデリン沈着症4例、低体温、過敏症、再発非ホジキンリンパ腫、脳出血、うつ病、咳嗽および蕁麻疹が各1例であった。
主な副作用(レケンビ群で 2 例以上に発現した事象)
|
プラセボ群 |
レケンビ群 |
|
|---|---|---|
|
注入に伴う反応
|
64(7.1) |
234(26.1) |
|
アミロイド関連画像異常-微小出血およびヘモジデリン沈着
|
67(7.5) |
122(13.6) |
|
アミロイド関連画像異常-浮腫/滲出液貯留
|
15(1.7) |
113(12.6) |
|
脳表ヘモジデリン沈着症
|
20(2.2) |
47(5.2) |
|
頭痛
|
8(0.9) |
16(1.8) |
|
過敏症
|
6(0.7) |
15(1.7) |
|
疲労
|
3(0.3) |
5(0.6) |
|
発疹
|
1(0.1) |
5(0.6) |
|
脳出血
|
0 |
4(0.4) |
|
浮動性めまい
|
5(0.6) |
4(0.4) |
|
注入部位発疹
|
0 |
3(0.3) |
|
悪心
|
0 |
2(0.2) |
|
注入部位血管外漏出
|
3(0.3) |
2(0.2) |
|
注入部位反応
|
1(0.1) |
2(0.2) |
|
転倒
|
2(0.2) |
2(0.2) |
|
アラニンアミノトランスフェラーゼ増加
|
2(0.2) |
2(0.2) |
|
高コレステロール血症
|
0 |
2(0.2) |
|
平衡障害
|
1(0.1) |
2(0.2) |
|
記憶障害
|
0 |
2(0.2) |
|
緊張性頭痛
|
0 |
2(0.2) |
|
錯乱状態
|
2(0.2) |
2(0.2) |
|
うつ病
|
3(0.3) |
2(0.2) |
|
蛋白尿
|
0 |
2(0.2) |
|
紅斑
|
0 |
2(0.2) |
|
起立性低血圧
|
0 |
2(0.2) |
MedDRA Version 25.0





